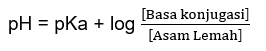Sifat-sifat dan Peran Larutan Penyangga
Proses
metabolisme dapat berlangsung jika pH cairan dalam tubuh stabil. Darah yang
terdapat dalam tubuh memiliki pH sekitar 7,4. Jika pH
darah berubah, kemampuan mengangkut oksigen ke seluruh tubuh akan berkurang.
Sebagai contoh enzim pepsin yang berfungsi memecah protein dalam lambung hanya
dapat bekerja optimal pada suasana asam yaitu sekitar 2. Apabila berada pada pH
yang berbeda jauh dengan pH optimal tersebut, enzim pepsin akan menjadi
nonaktif atau bahkan rusak. Untuk itu perlu adanya suatu sistem yang menjaga
nilai pH agar enzim tersebut dapat bekerja secara optimal. Oleh karena itu,
darah dan enzim memiliki sifat dapat mempertahankan pHnya atau termasuk larutan
penyangga.
Komponen
Larutan Penyangga
Kalau dalam
yang mengandung CH3COOH dan CH3COONa, atau NH3
dengan NH4Cl ditambahkan sedikit asam atau basa, akan didapat harga
pH seperti yang tertera pada Tabel 1.
Tabel 1. pH larutan
sebelum dan sesudah ditambah sedikit asam dan basa
No.
|
Jenis Zat
|
Volume
|
pH Awal
|
pH setelah ditambah 1 mL
|
HCl 0,1 M
|
NaOH 0,1 M
|
1.
|
Air
|
10 mL
|
7
|
3,0
|
11,0
|
2.
|
CH3COOH dan CH3COONa
|
10 mL
|
4,74
|
4,73
|
4,75
|
3.
|
NH3(aq)
dan NH4Cl
|
10 mL
|
9,27
|
9,30
|
9,32
|
(Sumber: Poppy et al., 2009: 205)
Pada data percobaan
tersebut campuran yang terdiri dari larutan CH3COOH dan CH3COONa,
juga larutan NH3(aq) dan NH4Cl pHnya hampir tidak berubah
setelah ditambah sedikit asam maupun sedikit basa. Kedua jenis campuran
tersebut merupakan contoh larutan penyangga.
Pada Tabel 1 terdapat dua macam larutan penyangga yaitu campuran antara CH3COOH
dengan CH3COONa dan NH3(aq)
dengan NH4Cl. Pada campuran CH3COOH
dengan CH3COONa yang membentuk larutan penyangga adalah CH3COOH
yang bersifat asam lemah dengan CH3COO– yang berasal dari
CH3COONa. CH3COO– adalah basa konjugasi dari
CH3COOH, maka komponen larutan penyangga ini adalah CH3COOH
dengan CH3COO–.
Pada campuran NH3(aq)
dengan NH4Cl yang membentuk larutan penyangganya adalah NH3
yang bersifat basa lemah dengan NH4+ dari NH4Cl.
NH4+ adalah asam
konjugasi dari NH3(aq), maka komponen larutan penyangga ini adalah
NH3(aq) dengan NH4+.
Berdasarkan ini, dapat disimpulkan:
Larutan
penyangga adalah larutan yang mengandung asam lemah dengan basa konjugasinya
atau basa lemah dengan asam konjugasinya. Larutan penyangga yang mengandung
asam lemah bersifat asam. Larutan penyangga yang mengandung basa lemah bersifat
basa.
Larutan
penyangga adalah larutan yang pH-nya tidak mudah berubah dengan penambahan
sedikit asam, basa, atau air. Larutan penyangga disebut juga larutan buffer
atau dapar. Larutan penyangga dapat dibuat dengan cara mencampurkan asam
lemah dengan garamnya atau basa lemah dengan garamnya.
Sifat larutan penyangga
dapat mempertahankan pHnya jika ditambah sedikit asam atau basa, dapat dilihat pada tabel data
dan grafik titrasi CH3COOH dengan NaOH berikut.

Gambar 1. Grafik perubahan pH asam lemah
dengan basa kuat pada titrasi 25 mL CH3COOH 0,1 M ditambahkan NaOH
0,1 M.
Pada grafik dapat
dilihat di antara A dan B, pH hampir tidak berubah walaupun penambahan basa
tetap dilakukan. Apa penyebabnya?
Coba reaksikan CH3COOH
dengan NaOH dengan volum di antara 10 sampai dengan 20 mL.
CH3COOH(aq)
+ NaOH(aq) → CH3COONa(aq) + H2O(l)
Selama penambahan
NaOH pada campuran akan terbentuk CH3COONa dan sisa asam CH3COOH.
Campuran CH3COOH dengan CH3COONa menghasilkan larutan penyangga.
Setelah CH3COOH habis bereaksi dengan NaOH tidak terjadilagi larutan
penyangga sehingga pH pada titrasi melonjak naik. Demikian pula pada tabel dan grafik titrasi
NH3(aq) dengan HCl pada Gambar 2. Di antara titik E dan F perubahan
pH relatif kecil, hal ini disebabkan terjadi larutan penyangga yang mengandung
komponen NH3(aq) dan NH4Cl.
Gambar
2. Grafik
perubahan pH basa lemah dengan asam kuat pada titrasi 25 mL NH3 0,1
M oleh larutan HCl 0,1 M
Larutan penyangga
dapat dibuat dengan dua cara. Pertama dengan cara mencampurkan langsung
komponen-komponennya yaitu suatu asam lemah dengan garamnya atau suatu basa
lemah dengan garamnya. Kedua dengan cara mencampurkan asam lemah dan basa kuat
dengan jumlah asam lemah yang berlebih atau mencampurkan basa lemah dan
asam kuat dengan jumlah basa lemah berlebih.
MACAM-MACAM
LARUTAN PENYANGGA
1.
Larutan Penyangga Asam
Larutan
penyangga asam dapat dibuat dari campuran asam lemah dengan basa konjugasinya
atau garamnya. Dalam larutan penyangga asam, terjadi keseimbangan antara asam
lemah (HX) dengan basa konjugasinya (X–)
menurut persamaan reaksi.
HX(aq) ⇄ H+ (aq) + F–(aq)
pH
larutan penyangga
Keterangan:
Ka =
tetapan kesetimbangan asam
nasam
= jumlah zat asam (mol)
Contoh
larutan penyangganya adalah CH3COOH dengan CH3COONa, CH3COOH
dengan (CH3COO)2Ba, HCOOH dengan HCOOK.
1.
Larutan Penyangga Basa
Larutan
penyangga basa dapat dibuat dari campuran basa lemah dengan asam konjugasinya
atau garamnya. Pada larutan penyangga basa juga terjadi reaksi seperti pada
larutan penyangga asam yaitu reaksi kesetimbangan antara basa lemah dan asam
konjugasinya. Berikut persamaan reaksi kesetimbangan tersebut.
MOH(aq) ⇄ M+ (aq) +
OH–(aq)
Konsentrasi konsentrasi
Tinggi
tinggi (garam)
(basa
lemah)
Berdasarkan reaksi kesetimbangan tersebut konsentrasi
ion OH– dalam larutan penyangga basa dapat ditentukan dengan
rumus berikut.
Keterangan:
Kb =
tetapan kesetimbangan basa
nb =
jumlah zat basa
Contoh larutan
penyangganya adalah NH3 dan (NH4)2SO4.
PRINSIP KERJA LARUTAN PENYANGGA
Larutan penyangga berperan untuk mempertahankan pH pada
kisarannya. Jika ke dalam air murni dan larutan penyangga CH3COOH/CH3COO–
ditambahkan sedikit basa kuat NaOH 0,01 M pada masing-masing larutan, maka apa
yang akan terjadi? pH air murni akan naik drastis dari 7,0 menjadi 12,0;
sedangkan pada larutan penyangga hanya naik sedikit dari 4,74 menjadi 4,82.
Mengapa bisa demikian? Larutan penyangga CH3COOH/CH3COO–
mengandung asam lemah CH3COOH dan basa konjugasi CH3COO–.
Jika ditambah NaOH, maka ion OH– hasil ionisasi NaOH akan
dinetralisir oleh asam lemah CH3COOH. Akibatnya, pH dapat
dipertahankan.
Gambar
3. Perbandingan larutan nonpenyangga dan larutan penyangga jika ditambah
sedikit basa kuat NaOH. (Sumber : Crys Fajar
Partana dan Antuni Wiyarsi, 2009: 186)
Pada prinsipnya sama saja. Ion H+ hasil ionisasi
HCl akan dinetralisir oleh basa konjugasi CH3COO–, sehingga
pH dapat dipertahankan. Larutan penyangga akan mempertahankan pH pada
kisarannya jika ditambahkan sedikit asam, sedikit basa, dan pengenceran.
PENGARUH PENAMBAHAN ASAM TAU BASA SERTA PENGENCERAN TERHADAP PH LARUTAN
PENYANGGA
Kapasitas atau daya
penahan larutan penyangga bergantung pada jumlah zat (n) dan perbandingan
jumlah zat (n) dari komponen penyangganya. Semakin banyak jumlah mol komponen
penyangga, semakin besar kemampuannya mempertahankan pH. Jika komponen asam
terlalu sedikit, penambahan sedikit basa dapat mengubah pH-nya. Sebaliknya,
jika komponen basanya terlalu sedikit, penambahan sedikit asam akan mengubah
pH-nya. Perbandingan mol antara komponen-komponen suatu larutan penyangganya
sebaiknya antara 0,1 hingga 10 karena di luar perbandingan tersebut sifat
penyangganya akan berkurang.
1. Penambahan
Asam atau Basa
Sifat larutan penyangga
yaitu dapat mempertahankan pH dari pengaruh penambahan sedikit asam maupun
sedikit basa. Pengaruh penambahan tersebut dapat dilihat pada kasus berikut
ini.
Larutan penyangga
dengan pH sebesar 4,7 dapat dibuat
dengan mencampurkan 100 mL larutan CH3COOH 0,2 M (Ka CH3COOH
= 10–5) dan 100 mL larutan CH3COONa 0,1 M. Apabila ke
dalam larutan penyangga tersebut ditambahkan 10 mL larutan HCl 0,1 M atau 10 mL
larutan NaOH 0,1 M maka perhitungan akibat penambahan sedikit asam kuat atau
basa kuat dapat dilihat sebagai berikut.
Sebelum penambahan HCl atau NaOH
CCH3COOH = 0,2 M
VCH3COOH = 100 mL = 0,1 L
Catatan:
C = konsentrasi (M atau mol/L)
V = Volume (L)
nCH3COOH = CCH3COOH
x VCH3COOH
nCH3COOH = 0,2 M x 0,1 L
nCH3COOH = 0,2 mol/L x 0,1
L = 0,02 mol
CCH3COONa = 0,1 M
VCH3COOH = 100 mL = 0,1 L
Catatan:
C = konsentrasi (M atau mol/L)
V = Volume (L)
n = jumlah zat
nCH3COONa = CCH3COONa
x VCH3COONa
nCH3COONa = 0,1 M x 0,1 L
nCH3COONa = 0,1 mol/L x 0,1
L = 0,01 mol
CH3COONa(aq) → CH3COO–(aq)
+ Na+(aq)
nCH3COONa = nCH3COO– = 0,01
mol
pH sebelum penambahan asam kuat dan basa kuat
Pada penambahan HCl pada campuran penyangga
nHCl = nH+
= 0,001
HCl(aq) → H+(aq)+ Cl–(aq)
VHCl = 10 mL = 0,01 L
CHCl = 0,1 M
nHCl = CHCl x VHCl
nHCl = 0,1 M x 0,01 L
nHCl = 0,1 mol/L x 0,01 L = 0,001
mol
mol
sehingga terjadi reaksi berikut
Pada campuran kedua larutan tersebut akan terjadi
reaksi kesetimbangan:
CH3COOH(aq) ⇄ CH3COO–(aq) + H+(aq)
Setelah ditambah HCl, jumlah zat (n) ion H+
diasumsikan sama dengan jumlah zat (n) HCl yang ditambahkan yaitiu 0,001
mol (H+ dari ionisasi asam asetat diabaikan). Semua ion H+
(dari HCl) yang ditambahkan akan bereaksi dengan ion asetat (basa konjugasi).
Oleh karena itu, penambahan asam (H+) akan mengurangi jumlah basa
konjugas (CH3COO–) dan sebaliknya
menambah jumlah asam lemah (CH3COOH). Persamaan reaksinya
sebagai berikut.
selisih pH setelah penambahan asam = 0,06
Penambahan sedikit basa kuat
Pada penambahan 10 mL NaOH 0,1 M pada campuran penyangga
NaOH(aq) → Na+(aq)+ OH–(aq)
VNaOH = 10 mL = 0,01 L
CNaOH = 0,1 M
nNaOH= CNaOH
x VNaOH
nNaOH = 0,1
M x 0,01 L
nNaOH = 0,1 mol/L x 0,01 L = 0,001 mol
nNaOH = nOH-
= 0,001 mol
Penambahan sedikit basa kuat (OH–)
akan bereaksi dengan asam lemah CH3COOH menurut persamaan reaksi
berikut.


Selisih pH setelah penambahan basa = 0,07 (naik 0,07)
Berdasarkan kasus di atas, dapat dilihat dari hasil
perhitungan bahwa penambahan sedikit asam atau basa hanya menggeser sedikit harga
pH (seperti pada penambahan asam kuat pH turun 0,06 dan penambahan sedikit basa
kuat pH naik 0,07) sehingga dapat diabaikan atau pH dianggap tetap.
Pengenceran
Berdasarkan persamaan Handerson-Hasselbalch:
dapat ditentukan bahwa pengenceran tidak memengaruhi
harga pH larutan penyangga.
Harga pH larutan penyangga hanya ditentukan oleh pKa
dan perbandingan konsentrasi molar pasangan asam basa konjugas. Sementara itu,
nilai Ka dan pKa dari asam lemah tidak bergantung pada
konsentrasi asam, tetapi bergantung pada suhu. Oleh karenanya, pengenceran larutan
penyangga tidak mengubah harga pKa. Konsentrasi molar pasangan
asam basa konjugasi akan berubah jika volume larutan tidak berubah. Hal ini
karena konsentrasi spesi yang ada dalam larutan. Namun, perubahan konsentrasi
terjadi pada semua spesi. Oleh karenanya, perbandingan konsentrasi molar pasangan
asam basa konjugasi atau perbandingan spesi tidak berubah sehingga pH larutan tidak
berubah.
Contoh pengaruh pengenceran pada pH larutan
penyangga:
Suatu larutan penyangga dibuat dengan mencampurkan
50 mL larutan HCOOH 0,5 M (Ka = 10–4) dengan 25 mL larutan HCOOK 1 M. Selanjutnya, larutan tersebut diencerkan dengan akuades
hingga volumenya 200 mL.
a.
Berapa pH larutan sebelum
diencerkan?
b.
Berapa pH larutan setelah
diencerkan?
Jawaban:
CHCOOH
= 0,5 M
VHCOOH = 50 mL = 0,05 L
nHCOOH=
CHCOOH x VHCOOH
nHCOOH
= 0,5 M x 0,05 L
nHCOOH= 0,5 mol/L x 0,05 L = 0,025 mol
CHCOOK
= 1 M
VHCOOK = 25 mL = 0,025 L
nHCOOK=
CHCOOK x VHCOOK
nHCOOK
= 1 M x 0,025 L
nHCOOK= 1 mol/L x 0,025 L = 0,025 mol
a. pH larutan
sebelum diencerkan
b. pH
larutan setelah diencerkan
Setelah diencerkan jumlah zat (n) HCOOH dan HCOOK tidak berubah, meskipun konsentrasi larutan
berubah sehingga pH tetap = 4
Vlarutan = 200 mL = 0,2 L
Jika pH dihitungkan berdasarkan konsentrasinya, maka:
Contoh Soal
1.
Sebanyak 1 L larutan berisi campuran antara larutan HCOOH
0,02 M dan larutan HCOOK 0,01 M. Tentukan pH larutan tersebut! (Ka HCOOH = 2 x 10–4)
Penyelesaian:
HCOOK(aq) → HCOO–(aq) + K+(aq)
[HCOO–] = [HCOOK] = 0,01 M
Jadi, pH larutan adalah 4 – log 4
2. Suatu
campuran terdiri atas 100 mL larutan NH3 0,2 M dan 50 mL larutan H2SO4
0,1 M. Jika diketahui Kb NH3 = 2 x 10–5,
tentukan pH campuran tersebut!
Penyelesaian:
CNH3
= 0,2 M
V NH3
= 100 mL = 0,1 L
n NH3
= CNH3 x VNH3
n NH3
= 0,2 M x 0,1 L
n NH3=
0,2 mol/L x 0,1 L = 0,02 mol
CH2SO4
= 0,1 M
VH2SO4
= 50 mL = 0,05 L
nH2SO4=
CH2SO4 x VH2SO4
nH2SO4
= 0,1 M x 0,05 L
nH2SO4=
0,1 mol/L x 0,05 L = 0,005 mol
pOH = –log [H+]
pOH = –log 2 x 10–5
pOH = 5 – log 2
pH = 14 – pOH
pH = 14 – (5 – log 2)
pH = 9 + log 2
Jadi, pH campuran tersebut adalah 9 + log 2
PERAN LARUTAN PENYANGGA
1.
Peran Larutan Penyangga dalam Tubuh Makhluk Hidup
pH darah tubuh manusia berkisar antara 7,35-7,45. pH
darah tidak boleh kurang dari 7,0 dan tidak boleh melebihi 7,8, karena akan berakibat fatal bagi manusia.
Organ yang paling berperan untuk menjaga pH darah adalah paru-paru dan ginjal. Kondisi
di mana pH darah kurang dari 7,35 disebut asidosis. Faktor-faktor yang mempengaruhi terjadinya kondisi
asidosis antara lain penyakit jantung, penyakit ginjal, kencing manis, dan
diare yang terus-menerus. Sedangkan kondisi di mana pH darah lebih dari 7,45
disebut alkolosis.
Kondisi
ini disebabkan muntah yang hebat, hiperventilasi (kondisi ketika bernafas
terlalu cepat karena cemas atau histeris pada ketinggian). Untuk menjaga pH
darah agar stabil, di dalam darah terdapat beberapa larutan penyangga alami.
a. Penyangga
hemoglobin
Oksigen
merupakan zat utama yang diperlukan oleh sel tubuh yang didapatkan melalui
pernapasan. Oksigen diikat oleh hemoglobin di dalam darah, di mana O2
sangat sensitif terhadap pH. Reaksi kesetimbangan yang terjadi dapat dituliskan
sebagai berikut.
HHb+
+ O2 ⇄ H+ + HbO2
Asam
hemoglobin
Produk
buangan dari tubuh adalah CO2 yang di dalam tubuh bisa membentuk
senyawa H2CO3 yang nantinya akan terurai menjadi H+ dan
HCO3–. Penambahan H+ dalam tubuh akan
mempengaruhi pH, tetapi hemoglobin yang telah melepaskan O2 dapat
mengikat H+ membentuk asam hemoglobin.
b. Penyangga karbonat
Penyangga
karbonat juga berperan dalam mengontrol pH darah. Reaksi kesetimbangan yang
terjadi sebagai berikut.
H+(aq)
+ HCO–(aq) ⇄
H2CO3(aq) ⇄
H2O(aq) + CO2(aq)
Perbandingan
molaritas HCO3–
terhadap H2CO3 yang diperlukan untuk mempertahankan pH
darah 7,4 adalah 20:1. Jumlah HCO3– yang relatif jauh lebih banyak itu
dapat dimengerti karena hasil-hasil metabolisme yang diterima darah lebih
banyak bersifat asam.
c. Penyangga fosfat
Penyangga
fosfat merupakan penyangga yang berada di dalam sel. Penyangga ini adalah
campuran dari asam lemah H2PO4– dan basa konjugasinya, yaitu HPO42–.
Jika dari proses metabolisme sel dihasilkan banyak zat yang bersifat asam, maka
akan segera bereaksi dengan ion HPO42–.
HPO42– (aq) + H+(aq) ⇄ H2PO4– (aq)
Dan jika
pada proses metabolisme sel menghasilkan senyawa yang bersifat basa, maka ion
OH– akan bereaksi dengan ion H2PO4–,
H2PO4– (aq) + OH–(aq) ⇄ HPO42– (aq) + H2O(l)
Sehingga
perbandingan [H2PO4–]/[ HPO42–] selalu tetap dan akibatnya
pH larutan tetap. Penyangga ini juga ada di luar sel, tetapi jumlahnya sedikit.
Selain itu, penyangga fosfat juga berperan sebagai penyangga urin.
2.
Peran Larutan Penyangga dalam Kehidupan Sehari-hari
Larutan penyangga digunakan dalam berbagai bidang,
seperti kimia analisis, biokimia, bakteriologi, obat-obatan (farmasi),
fotografi, industri kulit, zat warna, industri makanan, pertanian, dan
pengolahan limbah industri. Rentang pH tertentu yang sempit diperlukan untuk
mencapai hasil optimum dalam berbagai bidang tersebut. Misal suatu enzim dapat
bekerja pada pH tertentu dan sangat sensitif terhadap perubahan pH.
a. Peran
larutan penyangga dalam industri makanan
Bidang industri makanan, misalnya pengalengan buah-buahan juga membutuhkan
larutan penyangga, yang berfungsi mengatur kadar keasaman (pH), misalnya asam
sitrat dan natrium sitrat. Kedua zat tersebut merupakan larutan penyangga yang
biasa ditambahkan pada buah-buahan yang dikalengkan. Selain itu, asam sitrat
yang biasa digunakan untuk mengatur tingkat keasaman pada produk susu, selai
dan jeli.
b. Peran
larutan penyangga dalam bidang farmasi
Dalam bidang farmasi, senyawa MgO digunakan dalam pembuatan aspirin. Komponen
utama aspirin berupa asam asetilsalisilat yang mampu menghilangkan rasa nyeri
dan mengubah pH dalam perut. Perubahan pH ini mengakibatkan pembentukan hormon yang
merangsang proses penggumpalan darah menjadi terhambat sehingga pendarahan
tidak dapat dihindarkan. Oleh karena itu, pada onat aspirin ditambahkan MgO
yang dapat mentransfer kelebihan asam.
DAFTAR
PUSTAKA
Crys
Fajar Partana dan Antuni Wiyarsi. 2009. Mari Belajar Kimia 2 : Untuk SMA XI
IPA. Jakarta: Pusat Perbukuan, Departemen Pendidikan Nasional.
Emi
Sulami dan Anis Dyah Rufaida. 2009. Buku Panduan Pendidik Kimia Untuk SMA/MA
Kelas XI. Klaten: PT Penerbit Intan Pariwara.
Poppy K.
Devi, et al. 2009. Kimia
2 : Kelas XI SMA dan MA.
Jakarta:
Pusat Perbukuan, Departemen Pendidikan Nasional.
Qurniawati,
Annik et al. 2018. Kimia Peminatan Matematika dan Ilmu Alam SMA/MA
Kelas XI Semester 2. Klaten: PT Penerbit Intan Pariwara.